Tipos De Misturas – Manual Da Química: Adentre o fascinante mundo da química, onde a matéria se revela em suas infinitas combinações! Nesta jornada, desvendaremos os segredos das misturas, desde as mais simples às mais complexas, explorando sua classificação, métodos de separação e propriedades intrínsecas. Prepare-se para uma imersão no universo microscópico, onde cada partícula conta uma história, e a interação entre elas define as características de cada substância.
Exploraremos a diferença crucial entre misturas homogêneas e heterogêneas, analisando exemplos do cotidiano que demonstram a presença dessas misturas em nosso dia a dia. Aprenderemos a identificar o tipo de mistura através da observação de suas fases, e dominaremos técnicas eficazes para separá-las, desde a simples decantação até a sofisticada cromatografia. Finalmente, mergulharemos no estudo das soluções, compreendendo sua solubilidade, concentração e os fatores que influenciam esses aspectos, abrindo caminho para o cálculo preciso de suas concentrações.
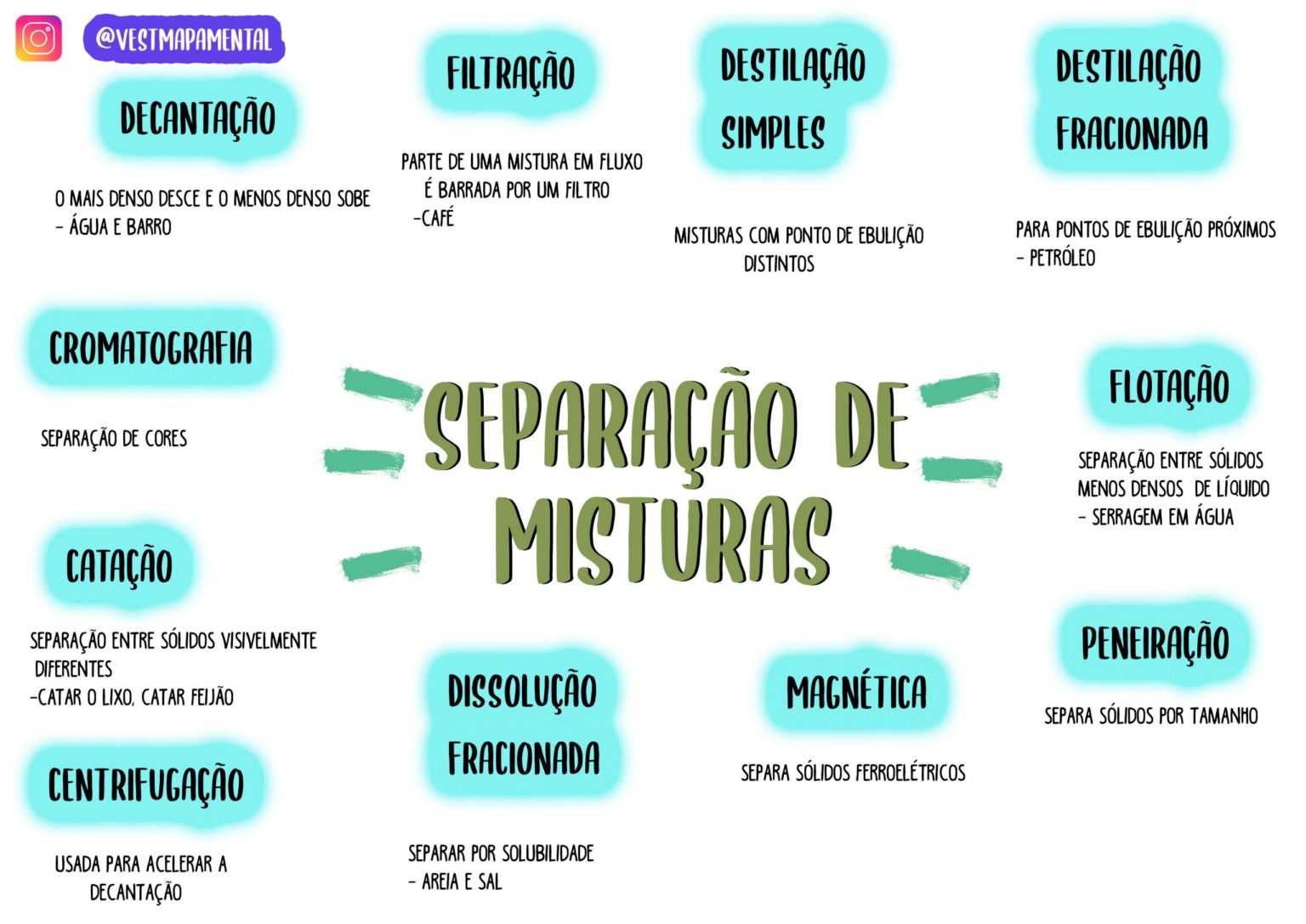
Métodos de Separação de Misturas
A alquimia da separação! A capacidade de isolar componentes de uma mistura é fundamental em diversas áreas, desde a purificação de água potável até a produção de medicamentos. Compreender os métodos de separação nos permite desvendar os segredos da matéria, separando os seus constituintes e revelando sua verdadeira natureza. A escolha do método ideal depende, crucialmente, das propriedades físicas dos componentes da mistura.
A separação de misturas é um processo que envolve a utilização de diferentes técnicas, cada uma adaptada para lidar com um tipo específico de mistura. Essas técnicas exploram as diferenças nas propriedades físicas dos componentes, como ponto de ebulição, solubilidade, densidade e tamanho de partícula. Vamos mergulhar nesse universo fascinante e desvendar os principais métodos utilizados.
Filtração
A filtração é um método eficiente para separar misturas heterogêneas, especialmente aquelas que contêm sólidos insolúveis em um líquido. Imagine um rio caudaloso carregando sedimentos – a filtração seria como um filtro natural, retendo as impurezas sólidas enquanto a água limpa flui. O processo consiste em passar a mistura através de um material poroso (filtro), que retém as partículas sólidas, permitindo que o líquido passe.
Um exemplo cotidiano é a filtração da água para remover impurezas, utilizando filtros de água domésticos ou em estações de tratamento de água. Em laboratório, usa-se papel de filtro em funil para separar sólidos de líquidos.
Decantação
A decantação é um método simples e elegante para separar misturas heterogêneas de líquidos imiscíveis (que não se misturam) ou de um sólido insolúvel em um líquido. Imagine o óleo e a água numa garrafa – suas densidades diferentes permitem a separação por decantação. Baseia-se na diferença de densidade entre os componentes: o componente mais denso sedimenta no fundo do recipiente, permitindo que o componente menos denso seja cuidadosamente separado.
Um exemplo clássico é a separação de água e óleo, onde a água, mais densa, se deposita no fundo, permitindo a remoção cuidadosa do óleo.
Destilação Simples
A destilação simples é uma técnica utilizada para separar misturas homogêneas líquido-líquido, onde os componentes possuem pontos de ebulição significativamente diferentes. É como separar as notas de um perfume complexo – cada componente evapora a uma temperatura específica. O processo envolve aquecer a mistura até que o componente com menor ponto de ebulição entre em ebulição, formando vapor que é então resfriado e condensado em um líquido separado.
A obtenção de água potável a partir da água do mar é um exemplo de destilação em larga escala.
Destilação Fracionada
A destilação fracionada é uma técnica refinada para separar misturas homogêneas líquido-líquido com pontos de ebulição próximos. Imagine a complexidade de um petróleo bruto – a destilação fracionada permite separar seus diferentes componentes, como gasolina, querosene e óleo diesel. Utilizando uma coluna de fracionamento, que proporciona múltiplas etapas de vaporização e condensação, é possível separar os componentes de forma mais eficiente do que na destilação simples.
A refinaria de petróleo utiliza a destilação fracionada para separar os diferentes componentes do petróleo bruto.
Cristalização, Tipos De Misturas – Manual Da Química

A cristalização é um método para separar sólidos dissolvidos em um líquido, baseado na diferença de solubilidade dos componentes em diferentes temperaturas. É como criar um jardim de cristais – a partir de uma solução saturada, os cristais se formam gradualmente. A solução é aquecida para aumentar a solubilidade do soluto, e em seguida, resfriada lentamente, permitindo a formação de cristais puros do sólido.
A obtenção de sal de cozinha a partir da água do mar é um exemplo clássico de cristalização.
Extração
A extração é um método para separar componentes de uma mistura utilizando um solvente seletivo. É como extrair o aroma de um especiaria – um solvente específico dissolve apenas o componente desejado. Um solvente adequado dissolve o componente desejado, enquanto os outros componentes permanecem na fase original. A extração de cafeína do café utilizando água quente é um exemplo de extração sólido-líquido.
Cromatografia
A cromatografia é uma técnica poderosa para separar misturas complexas, baseada na diferente afinidade dos componentes por duas fases: uma estacionária e outra móvel. Imagine um corredor de obstáculos molecular – cada componente “corre” a uma velocidade diferente, dependendo da sua afinidade com as fases. Os componentes são separados com base em suas diferentes velocidades de migração. A separação de pigmentos em uma folha de planta é um exemplo de cromatografia.
Centrifugação
A centrifugação é um método utilizado para separar misturas heterogêneas com base na diferença de densidade dos componentes. É como um redemoinho em miniatura – a força centrífuga força os componentes mais densos para o fundo do tubo. A mistura é submetida a uma rotação rápida, fazendo com que as partículas mais densas se sedimentem no fundo do tubo, separando-se das partículas menos densas.
A separação de componentes sanguíneos (plasma, glóbulos vermelhos e brancos) é um exemplo de aplicação da centrifugação.
Comparação dos Métodos de Separação
| Método | Tipo de Mistura | Princípio de Separação | Exemplo |
|---|---|---|---|
| Filtração | Heterogênea (sólido-líquido) | Tamanho de partícula | Separação de areia e água |
| Decantação | Heterogênea (líquido-líquido ou sólido-líquido) | Densidade | Separação de água e óleo |
| Destilação Simples | Homogênea (líquido-líquido) | Ponto de ebulição | Purificação de água |
| Destilação Fracionada | Homogênea (líquido-líquido) | Ponto de ebulição | Refino de petróleo |
| Cristalização | Homogênea (sólido-líquido) | Solubilidade | Obtenção de sal de cozinha |
| Extração | Homogênea ou Heterogênea | Solubilidade | Extração de cafeína do café |
| Cromatografia | Homogênea ou Heterogênea | Afinidade por diferentes fases | Separação de pigmentos |
| Centrifugação | Heterogênea | Densidade | Separação de componentes sanguíneos |
Roteiro Experimental: Separação de Areia, Sal e Água
Para separar uma mistura contendo areia, sal e água, podemos utilizar três métodos: decantação, filtração e evaporação (um tipo de cristalização).
- Decantação: Inicialmente, deixamos a mistura em repouso por algum tempo para que a areia, por ser mais densa, se sedimente no fundo do recipiente. Cuidadosamente, transferimos a água com o sal dissolvido para outro recipiente, deixando a areia no primeiro.
- Filtração: Utilizamos um funil com papel de filtro para separar a areia que pode ter sido transferida junto com a água salgada. A areia ficará retida no papel de filtro, e a solução de água salgada passará para um novo recipiente.
- Evaporação: Finalmente, aqueceremos a solução de água salgada. A água evaporará, deixando o sal sólido no recipiente.
Soluções e suas Propriedades: Tipos De Misturas – Manual Da Química
A dança invisível das moléculas, um ballet microscópico que define o mundo ao nosso redor, é o que torna as soluções tão fascinantes. Um universo de interações sutis, onde solutos se dissolvem em solventes, criando um novo todo com propriedades únicas. Exploraremos aqui a intrincada beleza desse processo, desvendando os segredos da solubilidade, concentração e os fatores que influenciam essa alquimia molecular.
As soluções, sistemas homogêneos formados por duas ou mais substâncias, revelam um comportamento peculiar determinado pela interação entre soluto e solvente. A solubilidade, a capacidade máxima de um soluto se dissolver em um determinado solvente a uma temperatura e pressão específicas, é a chave para entender a natureza dessas misturas. Imagine o açúcar se dissolvendo em água: as moléculas de açúcar, inicialmente agrupadas, são cercadas pelas moléculas de água, que, através de forças intermoleculares (como ligações de hidrogênio), as “arrancam” e as dispersam individualmente, formando uma solução homogênea.
A concentração, por sua vez, indica a quantidade de soluto presente em uma determinada quantidade de solução. Quanto mais soluto, mais concentrada a solução. E esse delicado equilíbrio é influenciado por diversos fatores.
Fatores que Influenciam a Solubilidade
A solubilidade não é uma constante imutável; ela é sensível a mudanças de temperatura, pressão e à própria natureza do soluto e solvente. Um aumento na temperatura, geralmente, aumenta a solubilidade de sólidos em líquidos, pois fornece energia extra para romper as forças intermoleculares que mantêm o soluto unido. A pressão, por sua vez, exerce maior influência na solubilidade de gases em líquidos.
Quanto maior a pressão, maior a solubilidade do gás, como demonstrado pela Lei de Henry. A natureza polar ou apolar do soluto e solvente também é crucial: “semelhante dissolve semelhante”. Substâncias polares tendem a se dissolver em solventes polares (como água), enquanto substâncias apolares se dissolvem em solventes apolares (como benzeno).
O Processo de Dissolução em Nível Molecular

A dissolução é um processo dinâmico, uma dança constante entre as moléculas de soluto e solvente. Imagine um cristal de cloreto de sódio (NaCl) sendo adicionado à água. As moléculas de água, polares, são atraídas pelos íons Na+ e Cl- do sal. As moléculas de água circundam os íons, enfraquecendo as fortes forças eletrostáticas que os mantêm unidos no cristal.
Esse processo, chamado de solvatação (ou hidratação, no caso da água), envolve a formação de ligações íon-dipolo, onde os polos negativos das moléculas de água interagem com os íons Na+, e os polos positivos com os íons Cl-. Este processo continua até que o cristal se desintegra completamente, e os íons ficam dispersos uniformemente na solução. Uma representação esquemática mostraria moléculas de água rodeando os íons Na+ e Cl-, com os polos positivos e negativos da água apontando para os íons de carga oposta.
Cálculo da Concentração de uma Solução
Expressar a concentração de uma solução é fundamental para descrever sua composição e realizar cálculos estequiométricos. Existem diversas maneiras de fazê-lo, cada uma com suas aplicações específicas.
A porcentagem em massa (% m/m) indica a massa do soluto em gramas presente em 100 gramas de solução. Por exemplo, uma solução de NaCl a 10% m/m contém 10g de NaCl em 100g de solução. A molaridade (M) representa o número de mols de soluto por litro de solução. Uma solução 1M de NaCl contém 1 mol de NaCl em 1 litro de solução.
A molalidade (m), por sua vez, indica o número de mols de soluto por quilograma de solvente. Uma solução 1m de NaCl contém 1 mol de NaCl em 1 kg de água.
Por exemplo, para preparar 250 mL de uma solução de NaCl 0,5 M, precisamos calcular quantos gramas de NaCl são necessários. A massa molar do NaCl é aproximadamente 58,5 g/mol. Portanto, 0,5 mol/L
- 0,25 L = 0,125 mol de NaCl. 0,125 mol
- 58,5 g/mol = 7,31 g de NaCl. Precisamos dissolver 7,31 g de NaCl em água suficiente para completar 250 mL de solução.

