Exemplo De Ação De Dissolução De Solução De Estável Mais: a aparente imobilidade de uma solução, sua estabilidade, é uma ilusão. A dança molecular, constante e invisível, pode ser quebrada. Exploremos os fatores que perturbam esse equilíbrio, desde a temperatura e a pressão até a intrusão de outras substâncias, desvendando o mistério da dissolução e a fragilidade da estabilidade.
Veremos como diferentes tipos de soluções respondem a essas mudanças, observando o comportamento de substâncias iônicas e covalentes em diversos solventes. A jornada pela compreensão da dissolução é uma viagem ao coração da química, revelando a dinâmica sutil que governa o mundo microscópico.
Este estudo detalha os mecanismos de dissolução, classificando soluções (saturadas, insaturadas, supersaturadas) e analisando sua estabilidade sob diferentes condições. A influência de fatores como temperatura, agitação e tamanho de partícula na velocidade de dissolução será examinada. Exploraremos métodos para prevenir a dissolução indesejada, incluindo a utilização de estabilizantes, e analisaremos aplicações práticas em diversas áreas, desde a indústria farmacêutica até a produção de alimentos.
O objetivo é desvendar a complexidade da dissolução, fornecendo uma visão abrangente e aplicada deste processo fundamental.
Dissolução de Soluções Estáveis: Uma Perspectiva Batak: Exemplo De Ação De Dissolução De Solução De Estável Mais

A compreensão da dissolução de soluções estáveis é fundamental em diversas áreas, desde a preparação de remédios até a produção industrial de alimentos e materiais. No contexto da cultura Batak, onde a observação da natureza e a manipulação de materiais são práticas ancestrais, o conhecimento da estabilidade e dissolução de soluções se torna ainda mais relevante, permitindo uma melhor compreensão dos processos naturais e artificiais que moldam nosso dia a dia.
Introdução ao Conceito de Dissolução
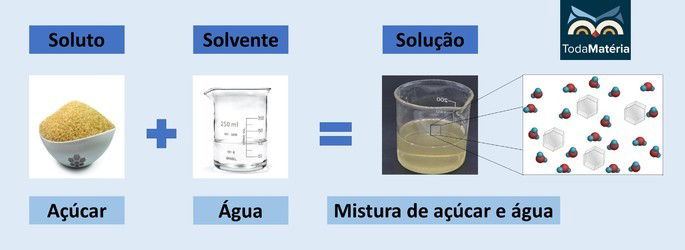
Dissolução é o processo onde um soluto (substância que se dissolve) se dispersa uniformemente em um solvente (substância que dissolve o soluto), formando uma solução homogênea. Em uma solução estável, o soluto permanece dissolvido sem precipitar ou separar-se do solvente por um período considerável. Imagine o açúcar se dissolvendo em água: o açúcar (soluto) se dispersa completamente na água (solvente), formando uma solução aquosa de sacarose.
A dissolução de uma solução estável, portanto, implica em uma quebra dessa homogeneidade, levando à separação do soluto e/ou formação de novas fases.
Substâncias iônicas, como o cloreto de sódio (sal de cozinha), dissolvem-se facilmente em solventes polares como a água, devido à interação eletrostática entre os íons e as moléculas de água. Já substâncias covalentes, como o açúcar, a dissolução depende da polaridade da molécula e da sua interação com o solvente. Por exemplo, o açúcar dissolve-se bem em água (polar), mas mal em óleo (apolar).
A velocidade de dissolução é influenciada por fatores como temperatura (maior temperatura, maior velocidade), agitação (maior agitação, maior velocidade) e tamanho de partícula (partículas menores, maior velocidade).
Tipos de Soluções e sua Estabilidade
Soluções podem ser classificadas em saturadas (concentração máxima de soluto dissolvido), insaturadas (concentração de soluto abaixo da saturação) e supersaturadas (concentração de soluto acima da saturação, geralmente instável). A estabilidade de uma solução depende de diversos fatores, incluindo a natureza do soluto e do solvente, temperatura, pressão e presença de outras substâncias. Soluções saturadas são, geralmente, mais estáveis que soluções supersaturadas, que tendem a precipitar o excesso de soluto.
| Tipo de solução | Exemplo | Fatores de estabilidade | Fatores de instabilidade |
|---|---|---|---|
| Saturada | Água com açúcar até o ponto de não dissolver mais | Baixa temperatura, baixa solubilidade do soluto | Aumento de temperatura, agitação |
| Insaturada | Água com pouco açúcar | Alta solubilidade do soluto, baixa temperatura | Adição de soluto, aumento de temperatura |
| Supersaturada | Solução de acetato de sódio preparada a alta temperatura e resfriada lentamente | Resfriamento lento, ausência de núcleos de cristalização | Agitação, introdução de impurezas, variação de temperatura |
| Estável (Exemplo adicional) | Sorvetes | Adição de estabilizantes, baixa temperatura, composição balanceada | Aumento de temperatura, tempo de armazenamento prolongado |
A estabilidade das soluções também varia com a temperatura e a pressão. O aumento da temperatura geralmente aumenta a solubilidade de sólidos em líquidos, enquanto o efeito da pressão é mais significativo em soluções de gases em líquidos.
Fatores que Causam a Dissolução de Soluções Estáveis
Diversos fatores podem levar à dissolução de uma solução estável além das mudanças de temperatura e pressão. A compreensão desses fatores é crucial para controlar a estabilidade de soluções em diferentes aplicações.
- Adição de um solvente miscível: A adição de um solvente miscível com o solvente original pode diluir a solução e alterar sua estabilidade.
- Reações químicas: Reações químicas entre o soluto e o solvente, ou entre o soluto e outras substâncias adicionadas, podem levar à formação de novos compostos e à precipitação do soluto.
- Variações de pH: Mudanças no pH da solução podem afetar a solubilidade do soluto e causar sua precipitação.
- Luz: A exposição à luz, especialmente à luz ultravioleta, pode causar reações fotoquímicas que degradam o soluto e alteram a estabilidade da solução.
- Contaminação: A introdução de impurezas na solução pode levar à formação de precipitados ou a reações químicas que comprometem a estabilidade.
Métodos para Prevenir a Dissolução de Soluções Estáveis, Exemplo De Ação De Dissolução De Solução De Estável Mais
A estabilidade de uma solução pode ser aumentada por meio de diversas estratégias, buscando minimizar os fatores que causam a dissolução.
- Adição de estabilizantes: Substâncias que inibem reações químicas ou a formação de cristais podem ser adicionadas para aumentar a estabilidade. Exemplo: uso de conservantes em alimentos.
- Controle de temperatura e pressão: Manter a solução em condições ideais de temperatura e pressão ajuda a prevenir a dissolução. Exemplo: armazenamento de remédios em geladeira.
- Proteção contra a luz: Armazenar a solução em recipientes opacos ou escuros previne reações fotoquímicas. Exemplo: armazenamento de soluções fotossensíveis em frascos âmbar.
- Filtração e purificação: Remover impurezas da solução antes do armazenamento ajuda a evitar reações indesejadas. Exemplo: filtração de soluções farmacêuticas.
Aplicações Práticas da Dissolução de Soluções

A dissolução de soluções tem aplicações amplas em diversas áreas. Na farmácia, a dissolução controlada de fármacos é crucial para a biodisponibilidade dos medicamentos. Na indústria alimentícia, a dissolução de açúcares, sais e outros compostos influencia o sabor, a textura e a estabilidade dos alimentos. Na indústria química, a dissolução é fundamental em processos de síntese, purificação e separação de substâncias.
Um exemplo de processo industrial que envolve dissolução controlada é a produção de xaropes farmacêuticos. Neste processo, um fármaco sólido (soluto) é dissolvido em um solvente apropriado (geralmente água purificada), sob agitação controlada e temperatura específica. O processo de dissolução é monitorado cuidadosamente para garantir a completa dissolução do fármaco e a homogeneidade da solução final. Após a dissolução completa, a solução é filtrada para remover quaisquer partículas insolúveis e, em seguida, acondicionada em frascos apropriados.
Um sistema de controle de temperatura e um agitador garantem a dissolução eficiente e uniforme do fármaco. O processo é projetado para evitar a formação de cristais ou qualquer outra alteração que comprometa a estabilidade e a qualidade do xarope final. O produto final é um xarope transparente e homogêneo, pronto para uso.

